近日,暨南大学化学与材料学院陈填烽教授/许利耕教授团队在新型疫苗佐剂开发方面取得重要进展,相关成果以“Universal Fe/Mn Nanoadjuvant with T1/T2 MRI Self-Navigation and Gas Generation for Ideal Vaccines with Precise Tracking”为题,发表于国际权威期刊ACS NANO(影响因子17.1),暨南大学为唯一通讯单位。这是该团队继开发纳米硒佐剂用于新冠病毒纳米疫苗(STTT, 2023)、灭活病毒纳米疫苗(Small Methods, 2023)等一系列研究工作后取得的又一重要成果。
开发安全高效的疫苗对于重大疾病如恶性肿瘤、烈性传染病(新型冠状病毒感染、高致病性禽流感等)的有效防治具有极其重要的临床意义。传统疫苗通常是灭活或减毒活疫苗,而其潜在的副作用如毒力回复等极大地限制了其在临床上的广泛应用。因此,非病毒疫苗,特别是纳米疫苗一直是疫苗领域的研究热点。目前,纳米材料作为疫苗载体或佐剂已显示出良好的应用前景,但在纳米佐剂/疫苗设计方面仍存在诸多挑战,极大地限制了纳米疫苗转化为临床应用。首先,纳米疫苗的免疫间隔等最佳免疫策略仍然未知,这在很大程度上决定了免疫反应的质量。不幸的是,目前纳米疫苗接种仍然主要参考传统疫苗的免疫策略,这显然不适用于纳米疫苗。其次,大多数报道的纳米疫苗的合成方法相对复杂,需要特定的昂贵设备和表面改性剂。第三,大多数报道的纳米材料,主要用作抗原载体,功能单一疫苗开发仍然需要佐剂或免疫增强剂。因此,开发具有影像功能且可反映疫苗体内代谢、免疫激活活性、高负载能力和诱导抗原交叉呈递等优点的纳米佐剂,对癌症、急性/烈性感染等重大疾病疫苗的开发具有重要指导意义和应用价值。
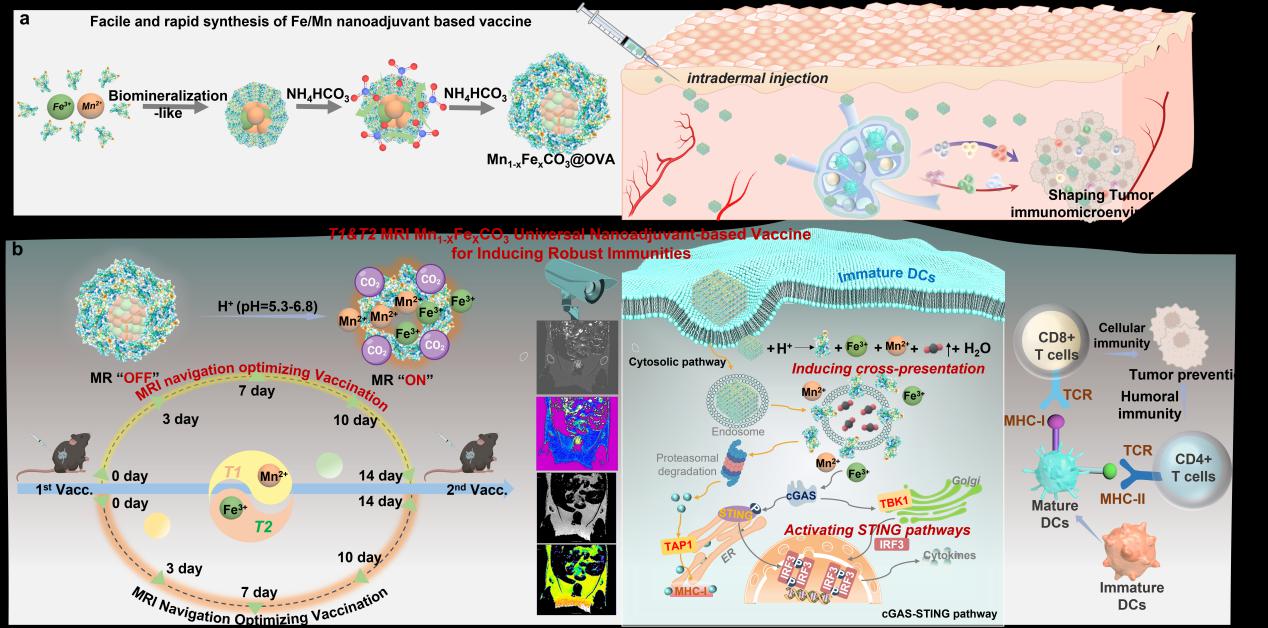
图1. 具有MRI自导航和气体生成功能的通用型铁/锰纳米佐剂用于癌症等重大疾病疫苗。
暨南大学陈填烽课题组一直致力于以临床问题为导向的化学创新药物设计与诊疗应用研究。聚焦于人体必需微量元素硒,在基于肿瘤生化特性的含硒靶向药物设计、放化疗增敏、抗病毒及免疫调控研究方面作了多年的工作积累(Matter, 2020;Sci Adv, 2020;Angew Chem Int Ed, 2020; J. Am. Chem. Soc., 2022; J. Am. Chem. Soc., 2023)。基于前期纳米疫苗构建的研究成果(Signal Transduct. Target. Ther., 2023;Small Method, 2023),近日暨南大学陈填烽教授和许利耕教授在新型疫苗佐剂开发方面取得重要进展,该团队设计了一个Fe3+掺杂的MnCO3纳米平台(Mn1−xFexCO3),该平台在免疫细胞溶酶体的酸性环境下表现出T1/T2双MRI成像模式。如图1所示,通过充分利用Mn2+/Fe3+与蛋白之间的生物矿化相互作用,使用气体扩散法成功开发了一种以卵清蛋白(OVA)为模型抗原的Mn1−xFexCO3基蛋白纳米疫苗。所制备的纳米疫苗对OVA表现出较高的负载效率,其在免疫细胞内的酸性环境下的降解赋予了纳米疫苗T1和T2 MR成像特性和活性,通过STING信号通路激活抗原呈递细胞,并通过气体生成和转运蛋白相关抗原加工1(TAP-1)转运蛋白诱导抗原交叉呈递。皮内接种Mn1−xFexCO3@OVA前后淋巴结体内MRI显示,间隔2周的免疫接种应是接种的最佳方式(图2)。在这一成像信息指导下,一系列体内实验表明,所开发的纳米疫苗能够高效地激活树突状细胞,诱导抗原交叉呈递,从而触发强大的抗原特异性免疫反应和随后的免疫记忆。所有这些优势都使开发的自导航纳米疫苗通过激活NOD样受体信号通路和Toll样受体信号通路,在预防表达OVA的黑色素瘤复发方面具有较好的效果。
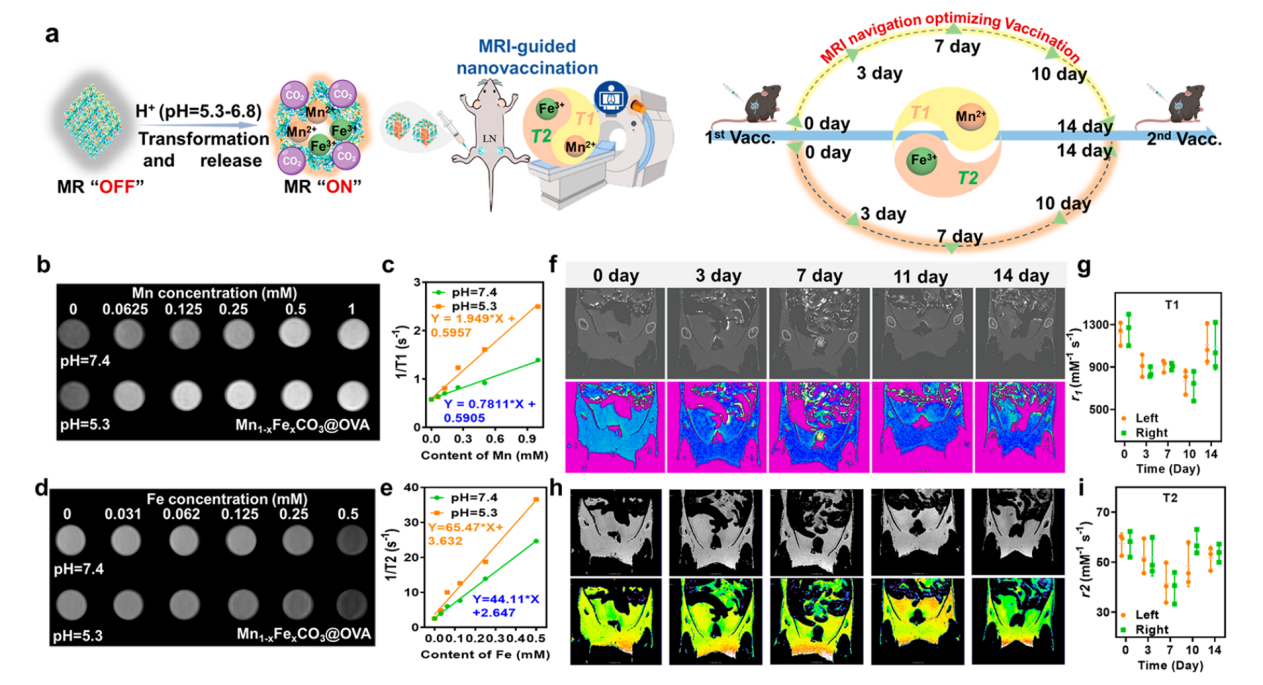
图2. Mn1−xFexCO3@OVA纳米疫苗展示出良好的T1/T2双模态MR成像特性,指导纳米疫苗精准免疫。
总之,本研究为开发新型纳米疫苗对抗烈性传染病等重大疾病提供了一种通用的自导航纳米佐剂,并为开发纳米疫苗的最佳免疫策略提供了重要指导。
论文第一作者为暨南大学黄炜博士后和硕士研究生施肃江,论文的通讯作者为许利耕教授和陈填烽教授。该研究得到了国家自然科学基金杰出青年基金、广东省自然科学杰出青年基金、国家自然科学基金青年基金和面上项目等资助。
原文链接:
https://pubs.acs.org/doi/full/10.1021/acsnano.3c02309
文/图:黄 炜
校对: 刘 雪
责编: 李逸凡
初审: 许利耕
终审: 李 丹