手性是自然界的本质属性之一,许多手性药物的药理作用是通过与体内大分子之间严格手性匹配与分子识别实现的。纳米粒子具有独特的尺寸和表面性质,被认为是扩大手性药物合成方法和治疗结果的理想平台。此外,在纳米粒子表面锚定手性分子可以使细胞表现出不同的手性偏好,从而提高手性药物的细胞摄取率。尽管在手性纳米材料的生物医学应用中取得了一些进展,但手性纳米颗粒在生物体内的分布、代谢和细胞抗氧化能力之间的联系尚未得到完全确定。
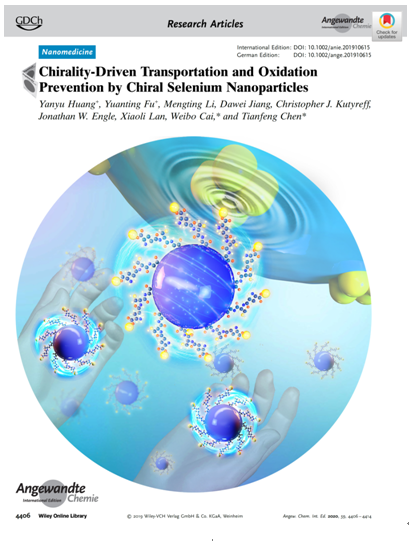
暨南大学的陈填烽教授一直致力于纳米化学创新药物的功能设计与肿瘤诊疗应用研究(Sci Adv, 2020, eaay9751; Adv Funct Mater 2019, 1901240; ACS Nano, 2018, 12401; Biomaterials, 2020, 119545等),利用纳米技术解决了微量元素硒在临床应用上的瓶颈。在前期纳米硒功能设计与疾病治疗应用的工作基础上,为了阐明手性在纳米硒发挥生物活性上的作用问题,陈填烽团队与威斯康星大学麦迪逊分校的蔡伟波教授合作,设计了不同手性纳米硒,利用无创性正电子发射断层扫描(PET)显像研究手性纳米硒的分布及代谢特征,并深入探讨了不同手性的纳米硒粒子对棕榈酸引起的胰岛细胞氧化损伤的预防保护作用差异,以及带来这种差异的分子机制。作者揭示了纳米系统的手性影响了其在肝脏,肠道和肾脏中的分布途径及定位速度。L-G @ SeNPs在肝脏,脾脏和胰脏中表现出优先积累,而DL和D型纳米粒子则逃避了肝脏的吸收,并经历了更快的肾脏清除。利用同源细胞粘附和摄取的优势,L-G@SeNPs更倾向于和细胞膜(含有L型磷脂分子)的相互作用来摄取纳米粒子,从而更有效防止了棕榈酸对胰岛细胞引起的氧化损伤,这符合自然选择的模式。该项工作为纳米硒在抗糖尿病引起胰岛损伤的应用上提供重要科学依据。
该论文“Chirality-driven transportation and oxidation prevention by chiral selenium nanoparticles”近日在国际顶尖期刊《Angewandte Chemie International Edition》上以Frontispiece发表(Angew. Chem. Int. Ed. 2020,59, 4406-4414),暨南大学黄妍瑜副研究员、硕士研究生傅元婷为共同第一作者,暨南大学陈填烽教授、威斯康星大学麦迪逊分校蔡伟波教授为通讯作者。研究工作获得了获得万人计划、国家863计划、国家自然科学基金项目等项目的资助。
作者介绍:
陈填烽,现任暨南大学暨南大学教授,一直致力于纳米化学创新药物的功能设计与肿瘤诊疗应用研究,获得万人计划青年拔尖人才项目、国家863计划、国家自然科学基金项目等多个项目的资助。近五年以通讯作者在Science Advances、Adv Funct Mater、Angew Chem Int Ed及ACS Nano等本领域主流杂志发表关于硒的研究论文超过200篇,封面论文32篇,h-index 54,申报中国专利50项,PCT专利2项,授权美国专利1项,实现技术成果转化8项。以第一完成人获得2018年中华医学科技奖青年科技奖、2018年广东省自然科学二等奖、2017广东省科技奖、2017中国产学研创新奖等科技奖励,推动了硒在生物医药与肿瘤精准诊疗领域的应用与发展。
蔡伟波,美国威斯康星大学麦迪逊分校放射学系、医学物理学系、生物医学工程系、材料科学与工程系及药学系Vilas杰出成就教授。主要从事分子影像及生物纳米科技的研究。在包括Nat Nanotechnol, CSR, ACR, PNAS, AM, ACIE, ACS Nano 等杂志发表论文300余篇(引用>20000次,H-index 80。获得了欧洲核医学学会斯普林格奖(2011 & 2013),美国癌症学会研究学者奖(2013-2017),美国医学与生物工程院(AIMBE)会士 (2018) 等奖项。